Batteridriftsprincip
Hvordan fungerer et vægur, en fjernbetjening til fjernsynet eller et radiostyret børnelegetøj? De fleste vil uden tøven svare "fra batterier", og i princippet vil de have ret. Men det er usandsynligt, at nogen af dem vil være i stand til at fortælle, hvordan nøjagtigt det bærbare batteri er tredoblet, hvordan det fungerer, og uden hvilken hele processen med at overføre elektrisk strøm fra batteriet til slutforbrugeren ville være umulig. Lad os udfylde dette irriterende hul i viden.
Artiklens indhold
Batteridriftsprincip
For at forstå princippet om drift af et konventionelt AA-batteri skal du have en generel forståelse af dets struktur. Så ethvert batteri består af tre hovedelementer - anode, katode og elektrolyt. Desuden kan sidstnævnte have praktisk talt enhver tilstand af aggregering: katoden og anoden placeret i en saltvandsopløsning er i princippet også et "batteri", kun i en form, der er usædvanlig for den gennemsnitlige person.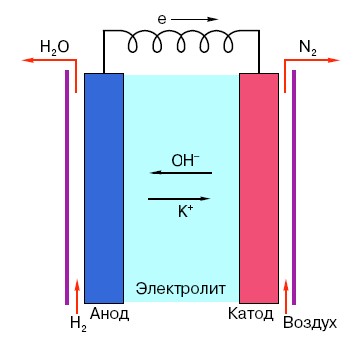
Interessant! Den såkaldte "voltaiske søjle", opfundet af Alessandro Volta, havde også alle de nødvendige elementer til produktion af elektrisk strøm. Den bestod af zink- og kobberplader stablet oven på hinanden, mellem hvilke der som "lag" blev lagt en klud gennemvædet i syre.
Anoden i sådanne systemer er hovedkilden til elektroner, der, som vi ved fra et fysikkursus i skolen, har en negativ ladning.Negativt ladede partikler tiltrækkes af positive, og i dette tilfælde fungerer katodeoverfladen som et "plus".
Men dette er ikke nok til, at der opstår en elektrisk strøm, fordi elektroner også har brug for en slags "motorvej" - et medium, der ville understøtte interaktionen mellem katoden og anoden. Det er her, at en elektrolyt vises "på scenen" - et salt, alkali eller syre, der er i stand til at lede strøm.
Lad os se på princippet om drift ved hjælp af et specifikt eksempel: der er et batteri vurderet til 18 volt. Spændingen mellem elektroderne i den er stabil, indtil den er tilsluttet netværket. Så snart en forbruger dukker op (for eksempel en almindelig pære), begynder spændingen gradvist at falde, strømmen begynder at strømme fra den "negative" elektrode til den "positive", og der sker en kemisk reaktion i elektrolytten rettet mod opretholdelse af potentialforskellen mellem elektroderne.
Reference. Jo mere energi forbrugeren har brug for, jo mere intens er reaktionen inde i batteriet, og jo hurtigere vil den fejle.
Hvordan fungerer et genopladeligt batteri, hvordan adskiller det sig fra et almindeligt
Så vi har set på de klassiske "finger" og "lille finger" batterier, og vi ved, at levetiden for de fleste af dem er strengt begrænset (uanset hvad berømte producenter siger). Men hvad med de såkaldte batterier - batterier af batteritypen, der ikke kun kan forbruge energi under reaktionsprocessen, men også akkumulere det og opbevare det i lang tid?
For at forstå princippet om batteriets drift er det nødvendigt at vende sig til kemi. Lad os tage som et eksempel... En almindelig kulild.Uanset hvor smuk og fascinerende flammen ser ud, ved enhver kemiker, der observerer den, at denne proces blot er en langsigtet reaktion af brændstofoxidation. Afbrænding af kul interagerer med ilt og som et resultat af denne reaktion får vi:
- carbondioxid;
- lys;
- varm.
Og hvis de sidste to punkter er i stand til at opvarme sjæl og krop, så kan vi ikke bruge kuldioxid på nogen måde, fordi det er et biprodukt af reaktionen, som i virkeligheden er dens affald. Oxidationsreaktionen stopper, når startelementerne: ilt og kul løber tør. At standse reaktionen i et batteri sker på nøjagtig samme måde, når udgangsstofferne er helt opbrugte og kun "affald" er tilbage.
I batteriet sker alting lidt anderledes. Faktum er, at reaktionen, der forekommer i den, tilhører kategorien reversibel, det vil sige, at den under visse betingelser kan "vendes" og returnere alle stoffer til deres oprindelige tilstand. Det er muligheden for, at der opstår en reversibel reaktion i batteriet, der gør det muligt at oplade det.
I et batteri tilsluttet netværket fortsætter reaktionen i den modsatte retning, og strømmen løber fra "plus" til "minus" og ikke omvendt. Som følge heraf danner reaktionsproduktet udgangsstofferne, og ejeren af batteriet modtager tilgængelig "genvundet" energi i et bærbart format. Det er alt!





